HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  ヒドロキシ酸/酸化金属を用いた高選択的リン酸化ペプチド濃縮法の開発
ヒドロキシ酸/酸化金属を用いた高選択的リン酸化ペプチド濃縮法の開発
08.04.10
ヒドロキシ酸/酸化金属を用いた高選択的リン酸化ペプチド濃縮法の開発
(08.04.10)
大規模な『リン酸化プロテオーム解析』に成功、がん細胞などに応用も
Sugiyama, N., Masuda, T., Shinoda, K., Nakamura, A., Tomita, M. and Ishihama, Y. (2007) Phosphopeptide Enrichment by Aliphatic Hydroxy Acid-modified Metal Oxide Chromatography for Nano-LC-MS/MS in Proteomics Applications., Mol Cell Proteomics, 6, 1103-9 ![]()
細胞内のタンパク質は、リン酸化やアセチル化、メチル化などの修飾を受けてその機能や活性を制御されている。特にリン酸化、または脱リン酸化によるタンパク質活性のON/OFF制御機構は、細胞内のシグナル伝達や代謝の調節において重要な役割を果たしている。細胞内に発現している全てのタンパク質のリン酸化レベルを網羅的に解析しようという研究が、リン酸化プロテオーム解析である。
リン酸化プロテオーム解析を行う上での最大の問題は、リン酸化されているタンパク質の割合がタンパク質全体のごく一部であり、非常に少ないということである。一般的なプロテオーム解析において用いられている測定法だけでは、リン酸化ペプチドは非リン酸化ペプチドのシグナルに埋もれてしまう。そのため、あらかじめリン酸化ペプチドを選択的に精製、濃縮する技術が必要となる。
リン酸化タンパク質、リン酸化ペプチド精製の従来法としては、IMAC(immobilized Metal Affinity Chromatography)法や、チタニアやジルコニアなどの酸化金属を用いた手法がある。しかしこれらの方法は、リン酸化ペプチド以外に酸性アミノ酸に富むペプチドの吸着も同時に起こるため、選択性の点で十分とは言えなかった。改良法としては、酸化金属クロマトグラフィー時に2,5-dihydroxy benzoic acid(2,5-DHB)を添加することで酸性ペプチドの吸着を抑える方法が開発されている。しかし、2,5-DHBは非常に疎水性が高く、逆相クロマトグラフィー時にペプチド画分と同時に溶出されてしまうため、LC-MS/MS(液体クロマトグラフィー-タンデム質量分析)を用いた方法には適さない。
そこで杉山博士らは、LC-MS/MS時にペプチドの検出を阻害せず、かつ実際の生体試料に応用可能なレベルでの選択性を持つリン酸化ペプチド濃縮法の開発に取り組んだ。酸化金属がグリコール酸や乳酸のような単純なα-ヒドロキシ酸に対しても親和性を示す、という知見にヒントを得て、さまざまなヒドロキシ酸を精製時に移動相*に添加し、リン酸化ペプチドの選択性にどのような影響がでるのか調べたのである。
その結果、チタニア使用時に乳酸を共存させると、非リン酸化ペプチドの吸着を抑える効果が最も高くなることが明らかになった。一方、ジルコニアに対してはβ-ヒドロキシ酸であるβ-ヒドロキシプロピオン酸(HPA)が最も良い効果を示した。どちらの条件についても、既に報告されている手法と比較して選択性、回収率ともに高く、そして最も重要なことに、これらの化合物は比較的親水性が強かった。すなわち、逆相クロマトグラフィーで容易にペプチド画分と分離することが可能であった。このようにして、LC-MS/MS法に適した、乳酸/チタニア法、およびHPA/ジルコニア法という高選択的手法の開発に成功したのである。
ところで研究当初、杉山博士らは測定データの再現性が得られずに悩んでいた。測定データは再現性が得られず、LC-MS/MSのクロマトグラム上にペプチド以外のピークが等間隔に観測されていた。そこで使用した移動相を調べたところ、調製後時間経過により溶液中のヒドロキシ酸がポリマー化していたのである。使用直前にヒドロキシ酸溶液を調製したところ、非常に再現性の高いデータが得られるようになったという。従って、ヒドロキシ酸共存下で酸化金属を用いたリン酸化ペプチド精製(HPA/ジルコニア法)を行う場合には、ヒドロキシ酸溶液の用時調製が注意点として挙げられる。
開発した手法は、刺激を与えていない状態のHeLa細胞におけるタンパク質のリン酸化解析に応用された。細胞抽出液のトリプシン消化物に対して乳酸/チタニア法、あるいはHPA/ジルコニア法によりリン酸化ペプチドを濃縮後、LC-MS/MSで分析したところ、実に1000個以上のリン酸化ペプチド、およびユニークなリン酸化サイトを決定することができた。この研究は、電気泳動やイオン交換などの前精製を併用せずに大規模なリン酸化プロテオーム解析に成功した初めての例である。
今回開発された手法を用いることで、刺激の有無によるリン酸化レベル変化や経時変化の解析が簡単になった。これによりますます多くの知見が蓄積され、細胞内シグナル伝達機構の網羅的な解明が進んでいくことと、大きな期待が寄せられている。
*移動相とは:試料を含んだ溶媒に相当する物質。液体クロマトグラフィーの場合、液体の固定層を移動して試料を分離させる役割を持つ。ここでは、水-アセトニトリル混合溶媒((A)0.5%酢酸、5%アセトニトリル、および(B)0.5%酢酸、80%アセトニトリル)を使用。
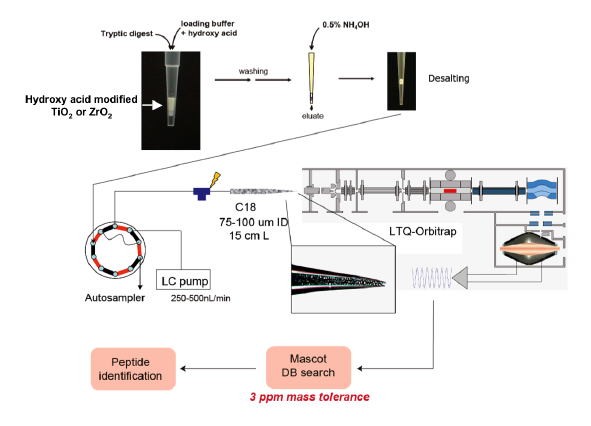
<図の説明>
リン酸化プロテオーム解析法の概要。(図上)ヒドロキシ酸/酸化金属法を用いたリン酸化ペプチドの濃縮。(図下)LC-MS/MSを用いたリン酸化ペプチドの測定とデータベース検索による同定。
[ 編集: 小川 雪乃 ]