HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  大腸菌の走化性における刺激応答・順応現象のシミュレーション解析
大腸菌の走化性における刺激応答・順応現象のシミュレーション解析
08.04.10
大腸菌の走化性における刺激応答・順応現象のシミュレーション解析
(08.04.10)
走化性受容体とCheタンパク質群の相互作用による新たな出力制御を示唆
Matsuzaki, Y., Kikuchi, S. and Tomita, M. Robust Effects of Tsr-CheBp and CheA-CheYp Affinity in Bacterial Chemotaxis. Artificial intelligence in medicine, 41(2) 145-150 ![]()
生物は、生きていくために重要な身の回りの環境の変化 -- 明るさや気温などの生理的条件、栄養源や有害物質などの化学的条件の変化を感知し、適切に対処する機能を備えている。環境からの刺激に応答して運動が起こる性質は『走性』と呼ばれており、光に応答する光走性(走光性)、化学物質に応答する化学走性(走化性)など様々な走性が知られている。
モデル生物である大腸菌の走性については特に研究が進んでいる。例えば大腸菌は、栄養源であるグルコース濃度が低下しcAMPが増加すると、べん毛の遺伝子を発現し栄養物質のより多い方へと移動する。その時、アスパラギン酸などの特定の物質の濃度変化を感知し、その情報を運動器官であるべん毛のモーターに伝えて泳ぐ向きを調節することが知られており、その分子生物学的な機構について既に多くの部分が明らかになっている(図1)。
ここで注目されるのは、大腸菌の走化性は物質の濃度そのものではなく、濃度の変化に対応しているという点である。大腸菌は環境中の化学物質の存在をなんらかの形で記憶し、少し前の時点よりも化学物質の量が増えている場合には直進を続けるシステムを持っていると考えられている。アスパラギン酸の刺激への応答機構は、受容体TarからCheA、CheYタンパク質を通じてシグナルが伝わり、その働きにCheR、CheB、CheZタンパク質が干渉することによって構成されている。これらの要素間での相互作用については、反応速度など生化学的なデータが多く得られている。また、アスパラギン酸の濃度が高くなるとより直進頻度を高くするような信号が伝わり(刺激応答)、徐々に高い濃度に順応して直進頻度を下げる(順応)、という現象が起きることが知られている。
これらのデータに基づいて、走化性システムが示す特徴を定量的に説明するための研究も進められている。刺激応答においては、少しの濃度変化に対して反応が対数的に起こるという刺激増幅現象が知られている。一方、細胞内部の状態が異なるものの、刺激を受ける前と順応後の出力(方向転換頻度)はほぼ同じ値に戻るという完全順応現象が知られている。これらの現象は共に数理モデルにより説明がなされている。刺激増幅現象は受容体どうしの相互作用を仮定したモデルで、完全順応現象は、システムの構造と化学反応の条件を仮定したモデルによって説明がなされている。では、この2つのモデルの性質を組み合わせれば、二つの性質を併せ持つシステムを再現できるのだろうか。
松崎博士らは、細胞シミュレーションシステムE-Cell Simulation Environmentを用いてこの問いに取り組んだ。まず、刺激増幅と完全順応のそれぞれを説明するために必要な要素を組みこみ、それぞれのタンパク質の量やリン酸化・メチル化などの修飾状態を動的に計算する数理モデルを構築した。このモデルを用いてシミュレーション実験を行ったところ、刺激増幅は再現することができたが、完全順応の性質は表現されなかった。これは、刺激増幅を説明するために必要な要素が、完全順応を説明するための仮定と一部反することが原因であると考えられた。
そこで、完全順応モデルでは考慮されていないが刺激増幅モデルには必要とされる各化学反応が、走化性システムに与える影響の大きさを解析した。各反応の速度を少しずつ変更してシミュレーション実験を繰り返し、どの反応が順応の正確さに大きく影響を与えているかを調べた結果、定義した反応のうち2つの反応が特に大きな影響を与えていることがわかった。いずれの反応も、受容体と細胞質内のタンパク質との相互作用に関する反応であった(図2)。
これまで、刺激増幅や順応現象の制御は、主に受容体の活性調節のレベルで行われているとされていた。ところが、今回のシミュレーション実験で得られた結果は受容体の活性調節とは別の段階、すなわち、細胞質内タンパク質との相互作用の段階で出力を制御する未知の機構があることを新たに示唆するものであった。
技術の向上に伴って蓄積された知見からシステムを再構築し、現象の再現性を問うことで、システムの構成要素の過不足を検証するアプローチはますます盛んになっている。今後は受容体と細胞質内タンパク質との相互作用機序に注目して研究を進めていきたい、と松崎博士は語った。
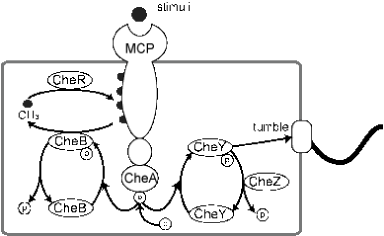
図1: 大腸菌走化性におけるシグナル伝達経路
自己リン酸化したCheAから、鞭毛モーターと相互作用するCheY、受容体を脱メチル化するCheBへとリン酸基が受け渡される。CheYpは菌体の方向転換を促す。受容体の修飾状態がCheAのリン酸化速度を制御しており、 受容体に誘引物質が結合するとCheAのリン酸化が抑制される。同時にCheBの脱メチル化活性が下がり、受容体のメチル化が進む。メチル化された受容体は誘引物質存在下でもCheAのリン酸化を進めるように作用する。
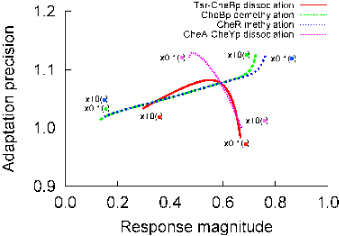
図2: 刺激応答と順応における正確さのプロット
アスパラギン酸が存在しない環境に10uMの刺激を与えた際の刺激応答幅(刺激投入に応じてシグナルタンパク質の修飾状態が変化した割合)と順応の正確さ(刺激投入前後のシステムの出力の比、値が1のとき完全順応とする)の関係。横軸は刺激への応答、縦軸は順応の正確さの指標を示す。受容体と複合体を形成しているCheAとCheYpの解離反応の速度を上げた場合、および、受容体とCheBpの解離反応の速度を下げた場合に刺激への反応が保たれ、順応も正確に行われている。
[ 編集: 小川 雪乃 ]