HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  超好熱性古細菌から見いだしたGTP依存性のRNA連結活性を有する新規酵素の解析
超好熱性古細菌から見いだしたGTP依存性のRNA連結活性を有する新規酵素の解析
09.05.14
超好熱性古細菌から見いだしたGTP依存性のRNA連結活性を有する新規酵素の解析
(09.05.14)
古細菌の断片化されたtRNAを連結する酵素を発見、新しいRNA連結メカニズムの存在を示唆
Kanai, A., Sato, A., Fukuda, Y., Okada, K., Matsuda, T., Sakamoto, T., Muto, Y., Yokoyama, S., Kawai, G. and Tomita, M., Characterization of a heat-stable enzyme possessing GTP-dependent RNA ligase activity from a hyperthermophilic archaeon, Pyrococcus furiosus, RNA,15(3), 420-431.![]()
![]()
tRNAはmRNAの有する情報をタンパク質へ変換する上で不可欠な分子である。多くの真性細菌(バクテリア)ではtRNAはそのまま転写される形でコードされているが、ヒトや酵母などの真核細胞生物や、高熱・高塩・高酸などの極限環境に生息する古細菌(アーキア)のtRNAには、DNAからの転写後に切りとられるイントロンを有するものが存在する。このイントロンを切り出すためにtRNAエンドヌクレアーゼと呼ばれる切断酵素が使われることはよく知られているが、イントロンを切り出した後に、断片化したtRNAを再び連結するような酵素に関してはほとんど分かっていなかった。
金井教授らのグループでは、これまでに超好熱性古細菌Pyrococcus furiosusのタンパク質ライブラリを用いたスクリーニング系を構築し、RNA関連タンパク質のプロテオームレベルでの同定を推し進めてきた。今回は、同ライブラリ中に見出したGTP依存性のtRNA連結活性を有するPF0027タンパク質について生化学的および構造生物学的な解析を行った。
PF0027は、184残基のアミノ酸からなる推定分子量21 kDaのタンパク質であり、2'-5' RNA リガーゼ(連結酵素)である大腸菌のLigT(20 kDa)とアミノ酸レベルで27%の相同性を示した。LigTにイントロンが除かれた酵母菌由来のtRNA断片の連結を行なう酵素活性があるので、この基質構造を模した合成RNAを用いてRNA リガーゼ活性を解析した(図1)。
その結果、基質となるtRNA断片の3'末端側に環状のリン酸が存在し、さらに5'末端側にOH基が存在した場合に、PF0027タンパク質はRNAリガーゼの活性を示すことが分かった。このtRNA断片は、生体内でtRNA前駆体がtRNAエンドヌクレアーゼにより切断された場合のRNA断片の末端構造と一致している。
また、NMR法にてPF0027タンパク質の高次構造を決定し、オリゴRNAの添加による化学シフト変化の解析からそのRNA結合領域を同定した。これは千葉工業大学、理化学研究所および東京大学との共同研究により達成することができた、と金井教授は語る。ここで、PF0027による連結反応にはGTPが必須であるがGTPの分解は必要ではなく、これまでにない新規のメカニズムによってRNAの連結が行われることを示唆している。
その一方で、PF0027によるRNA連結の効率は悪く、連結部位が3'-5'結合ではなく2'-5'結合であることからも、この酵素のみで生物学的に活性のあるtRNAの連結反応を遂行しているとは考えられなかった。金井教授らのグループは、tRNA連結に関わるさらなる因子の同定と、3'-5'結合反応の試験管内再構成を目指し、現在も挑戦を続けている。同グループがさきがけとなっている古細菌の断片化されたtRNAの謎を解き明かすパズルのピースは着実にそろいつつある。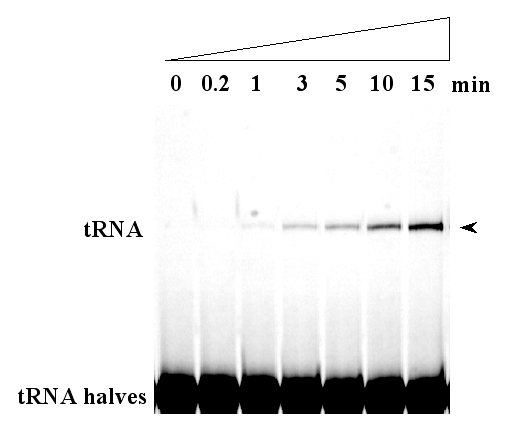
図1 精製したPF0027タンパク質による試験管内tRNA連結反応。化学合成したtRNAの5'側および3'側の各半断片と精製したPF0027タンパク質をGTPγS (GTPのアナログ)存在下にインキュベートすることで、各断片が連結した分子ができることを示している。