HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  CE-TOFMSによる胃がんおよび大腸がん組織のメタボローム解析
CE-TOFMSによる胃がんおよび大腸がん組織のメタボローム解析
09.10.14
CE-TOFMSによる胃がんおよび大腸がん組織のメタボローム解析
(09.10.14)
がん組織における未知のエネルギー獲得機構の解明へ
Hirayama, A., Kami, K., Sugimoto, M., Sugawara, M., Toki, N., Onozuka, H., Kinoshita, T., Saito, N., Ochiai, A., Tomita, M., Esumi, H. and Soga, T.Quantitative Metabolome Profiling of Colon and Stomach Cancer Microenvironment by Capillary Electrophoresis Time-of-Flight Mass Spectrometry. Cancer Res., 69(11), 4918-4925.![]()
![]()
がん細胞が,比較的酸素濃度が高い条件下においても,主に酸素を使わない解糖系によってエネルギー産生を行う現象はワーバーグ効果と呼ばれ,これまでに様々な がん種において観察されている.また,がん細胞は活発な増殖のために多量のグルコースを必要とし,近年のPET診断はまさにこの特性を利用した診断技術である.しかし,一部のがん種においては血流が乏しいために,慢性的な低酸素や極度の栄養不足状態にありながら生存・増殖していることが知られている.つまり,このような がん細胞におけるエネルギー産生は大量のグルコースを必要とする解糖系の亢進だけで説明することは難しく,血流量が多い栄養的に恵まれた環境下で増殖する がん種とは異なったエネルギー代謝を行っている可能性がある.そこで今回,平山研究員らのグループは,キャピラリー電気泳動-飛行時間型質量分析計(CE-TOFMS)を用いたメタボローム測定により,大腸がんおよび胃がん患者から採取した がん組織および正常組織の代謝物質を一斉分析し,がん組織のエネルギー産生のメカニズムに迫った.
その結果,CE-TOFMSを用いたメタボローム測定によって,16名の大腸がん患者と12名の胃がん患者の腫瘍組織中からそれぞれ平均877種類,1142種類の代謝物質由来のピークを得た(図1).これらの代謝物に関しては標準物質を用いて各サンプルの1 g臓器中の定量値を算出し,全サンプルの平均値をグラフに記載した.なおグルコースに関しては,液体クロマトグラフ-質量分析装置(LC-MS)を用いて定量値を算出した.
まず,腫瘍組織中のグルコース量は,正常組織中の量に比べて大腸がんで約1/10,胃がんでは約1/3程度であった.一方で,解糖系の中間物質量は非腫瘍組織と比べて同等かそれ以上であり,さらに解糖系の最終産物である乳酸量は両腫瘍組織中において有意に高かった.このことは,ワーバーグが報告した がんの培養細胞の実験で得た結果と一致しており,ヒトのがん組織でも解糖系が亢進していることが示唆された.
今回新たに明らかになったのは,クエン酸回路の代謝中間体である.胃では正常組織,がん組織ともクエン酸回路の代謝中間体は一定量存在している.しかし大腸ではどちらの組織でもクエン酸回路前半の代謝物(クエン酸からサクシニルCoAまで)がほとんど検出されておらず,ATP量も極めて低い.大腸の酸素分圧は胃のそれに比べて5分の1程度と報告されており,大腸では正常組織も がん組織も酸素を必要とする酸化的リン酸化反応はほとんど行われていないのではないかと推測される.
不思議なことに,特に大腸の がん組織では,クエン酸回路の後半部分の代謝物(コハク酸,フマル酸,リンゴ酸)が有意に増加していた.古くから嫌気性微生物や回虫などの寄生虫や二枚貝の一部では,嫌気的条件下でフマル酸呼吸と呼ばれる代謝によってATP産生が行われることが知られている.大腸がん組織ではコハク酸が蓄積しており,嫌気性条件下での回虫の代謝パターンと類似していた.
仮に大腸がんはフマル酸呼吸を行うとしても,それに必要なフマル酸はどこから供給されるのかという疑問が残る.図示していないが,今回の測定で得られたアミノ酸及びヌクレオチドの量を比較した結果,どちらのがん種においても,グルタミン以外のすべてのアミノ酸が有意に増加していた.血管新生が不十分な がん組織では,血液からのアミノ酸の供給も不足していると考えられるため,このアミノ酸の増加は不思議である.人体内で合成できない必須アミノ酸も増加していること,コラーゲンの分解によって特異的に生成されることが知られているヒドロキシプロリンが増加していることから,平山氏らは,オートファジーと呼ばれる細胞内のタンパク質分解機構によってアミノ酸ががん組織に供給されているのではないかという仮説を立てた.つまり,がん組織ではコラーゲンなどの周囲のたんぱく質を積極的に分解し,ATP産生を行うための前駆体としてアミノ酸を取り入れているのだろう.
今回のようにヒト体内の代謝物質量を計測するには,個人の生活環境の違いを考慮に入れてサンプルの選定に注意を払う必要がある.今回用いたサンプルは,一人の患者から手術で摘出した部位のうち腫瘍組織と正常組織をペアでとってきたものであり,そのような個人差の影響をある程度軽減することができる.これにより,代謝の違いをよりはっきり見ることができた.
今後の展望としては,より多くのがん組織で同じ研究を行うことで,各種のがんの代謝の違いをより体系的に捉え,代謝の違いをベースにした抗がん剤等の開発が可能になるのではないだろうかと平山氏は語る.今後の活躍に期待したい.
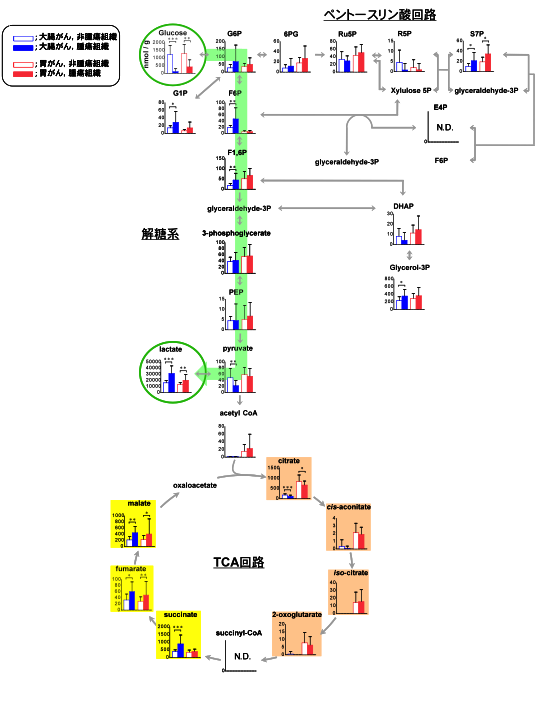
図.
中心炭素代謝(解糖系,ペントースリン酸回路,クエン酸回路のエネルギー代謝経路)に関わる代謝中間体の変動を代謝経路上にマッピングした結果.
各代謝物は組織1g中の物質量(nmol/g tissue)で表示している.
*,p<0.05; **,p<0.01; ***,p<0.001; N.D., Not detected