HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  がん細胞"死滅"へのキー分子の予測
がん細胞"死滅"へのキー分子の予測
12.06.19
がん細胞"死滅"へのキー分子の予測
(12.06.19)
細胞死促進へ向けた物理的法則性の解明
Piras, V*., Hayashi, K*., Tomita, M., Selvarajoo, K. (2011) Enhancing apoptosis in TRAIL-resistant cancer cells using fundamental response rules. Scientific Reports. 1:144.
腫瘍壊死因子関連アポトーシス誘導リガンド(tumor necrosis factor related apoptosis-inducing ligand;TRAIL)は、悪性腫瘍細胞にプログラムされた細胞死(アポトーシス)を誘導するが、他の細胞には有害な作用をおよぼさない。つまり、 TRAILを利用した がん治療が可能になれば、既存の薬物療法や放射線治療にくらべて大きく副作用を減らした治療が実現できる可能性がある。しかし、上皮性悪性腫瘍の中には TRAIL耐性がある腫瘍もあり、TRAILによるアポトーシスのシグナルを細胞生存シグナルへと切り替えてしまうため、TRAILによる治療の成功例は まだない。
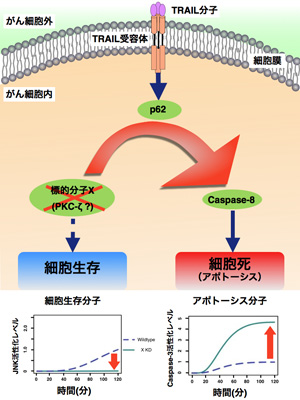
そこで、クマール・セルバラジュ特任講師らの研究グループでは、TRAILにより刺激したヒト繊維肉腫細胞におけるTRAIL耐性機構を検討する ための新たなシミュレーションモデルを開発した。そして、野生型およびいくつかの分子(FADD、RIP1、TRAF2、カスパーゼ-8)のノックダウン 条件下で、細胞生存に関与する分子(IκB、JNK、p38)とアポトーシスに関与する分子(カスパーゼ-8、カスパーゼ-3)の経時的活性化プロファイ ルを解析し、情報(シグナル伝達フラックス)保存の法則を利用した摂動応答アプローチに基づき、細胞集団レベルでの細胞応答の法則性を導き出した。
これらのアプローチから、p38とJNKを活性化するFADDとは独立した経路を持つこと、RIP1とp38間、そしてp62とJNK間には何らかのクロ ストークが存在すること、さらに、JNK上流の活性化プロセスの存在が予測された。特に、その後のシミュレーションから p62/sequestosome-1分岐点で新規分子を標的とすることで、シグナル伝達フラックスの再分配を介してアポトーシスが最適化されることが新 たに示唆された。つまり、この標的分子を取り除くことにより、TRAIL由来のシグナルのほとんどをアポトーシスのシグナルへと切り換えることができると 期待される結果となった。
現状ではまだコンピュータによる予測ではあるが、今後実験的な検証と組み合わせることでより確かな情報が得られるだろう。また、本手法は物理的法則に基づいた新規手法であるため、TRAILに限らず様々なシグナル伝達経路において汎用的に用いられることも期待される。
[ 編集:喜久田薫 ]