HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  心筋細胞の発生過程をたどる網羅的シミュレーション
心筋細胞の発生過程をたどる網羅的シミュレーション
14.03.13
心筋細胞の発生過程をたどる網羅的シミュレーション
(14.03.13)
胎生期の心臓を構成する心筋細胞の分化の機序をコンピュータで予測する
Okubo, C., Sano, HI., Naito, Y., Tomita, M. (2013). Contribution of quantitative changes in individual ionic current systems to the embryonic development of ventricular myocytes: a simulation study. J Physiol Sci. 63: 355-67.
成人の心臓を構成する心筋細胞は、心臓の拍動を制御するペースメーカー細胞や、刺激を受け取って収縮する細胞など、細胞の種類によって役割が分担されてい る。しかし実は胎児の未成熟な心臓では多くの心筋細胞が「一人二役」で働いており、成人の心臓におけるペースメーカー細胞のように拍動を制御しながら、収 縮・弛緩も行う「ポンプ」としての機能も果たしている。心臓の発生過程では、心臓自身の形や構成する細胞の役割分担を変えながら、未成熟な個体の全身に血 液や栄養分を常に運び続け、他の器官の成長を促す大切な使命を担っている。心臓が高度に分化しつつ常に拍動を維持する過程は、数分でも破綻すると個体の生 命に関わることから、緻密に制御されていると考えられるが、その全容は明らかになっていない。動物実験では胎生期における1つの心筋細胞の分化を追跡する のは難しく、複数のイオンチャネルの機能発現の変動を検証するのは困難であることから、自律的に拍動していた心筋細胞が、成熟して自律性を失い、大きな収 縮力をもつ受動的な心筋細胞へと変化する際に、細胞の電気的興奮をつかさどるイオンチャネルがどのように変化するかについては定量的な議論が不足してい る。
そこで、大久保氏らはコンピュータ・シミュレーションを用いて、心筋細胞の自律性の変化を電気生理学的に再現し、その要因を推定することに挑戦し た。大久保氏らはまず2007 年に発表した自律性を持つ胎生初期と自律性を持たない胎生後期の活動電位を再現できる心筋細胞モデル(Itoh et al. 2007) を用い、 胎生初期と胎生後期で電流密度の異なる9つの電流に着目した。さらに、胎生初期と胎生後期の中間段階としてありうる512 通りの状況について網羅的にシミュレーションを行った。 その結果、9つの電流のうち4つについては全体への影響が小さいことが示され、残る5つの電流の中でもNa+チャネル電流(INa)、ペースメーカー電流 (If)、内向き整流K+電流(IK1)の電流密度が、胎生初期/後期のいずれの値であるかによって自律性の有無が決定されることが示された。さらにシ ミュレーション結果は、胎生期の心室筋細胞でこれまでに報告されている特徴も再現していた。自律拍動は胎生期の心室筋細胞においても見られ、また胎生初期 の心室筋細胞の活動電位における脱分極を担っているL型Ca2+チャネル電流(ICaL)から胎生期を経るにつれてINaがその役割を担うことが明らかと なっているが、これらの傾向もシミュレーション結果において確認された。加えて、胎生期を経るにつれて静止膜電位がマイナス方向に大きく変動することも再 現されていた。
これらの結果により確認された1) INaの増加、2)Ifの消失、3)IK1の増加、が順番に起こる意義は、次のように説明される。まず自律的に拍動する細胞の活動電位であるICaLから 受動的に拍動する細胞の活動電位であるINaによって脱分極を行う細胞に分化する。また、これらの受動的に拍動する細胞において、自律的な活動電位を作り 出すIfが減少し、さらにペースメーカー細胞からの刺激を受けた時にのみ活動電位を作り出せるように静止膜電位を低く保つためのIK1の成長が必要とな る。以上のことから、本成果は自律性の消失や、発生過程における最大弛緩期電位や電流の役割の変化を説明する定量的な証拠となった。図1はこの順に変化さ せた場合の活動電位波形である。また、INaとIf の量が心筋細胞の自律的な拍動における基本周期長の決定に寄与し、IfとIK1の量によって細胞内Ca2+濃度が増加するケースがあることも明らかとなっ た。さらに、この細胞内Ca2+濃度の動態は、Kyoto model,Luo-Rudy model,ten-Tusscher model の3つの心筋細胞数理モデルにおいても同様に予測された(図2)。
本研究は、心筋細胞の分化の機序の解明を通して、ES 細胞やiPS 細胞から心筋細胞を分化させる再生医療への応用や、心疾患の新しい治療法の開発への貢献が今後大いに期待される。
図1: 自律的な活動電位の消失には3種のイオン電流が関わることが予測された。
黒字は胎生初期の電流密度、白字は胎生後期の電流密度に設定された電流を示す。左側の3つの結果は自律性を有しており、一番右側の全ての電流が胎生後期の場合では、自律性を消失しているが、外部刺激を印加することで活動電位の発生が見られる。
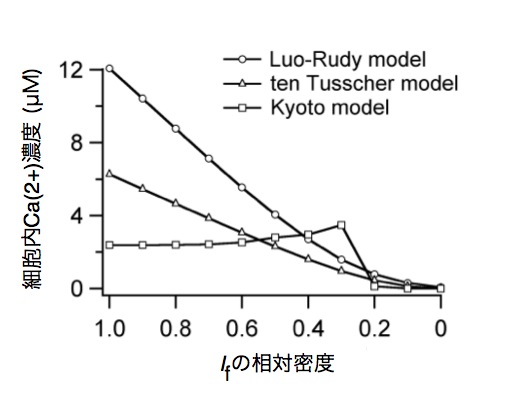
図2: Ifの相対密度と細胞内Ca2+濃度の関係
IK1 の相対密度を胎生後期の値に設定し、徐々にIfの相対密度を胎生後期の値に近づけるシミュレーションを3つの数理モデルで行った。Ifの相対密度を胎生初 期の値(1.0)に設定した組合せでは、全てのモデルにおいて、細胞内Ca2+濃度が異常に高い値になることが予測された。
[ 編集: 上瀧萌 ]