HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  DNAの材料「チミジン」の分解によるガン細胞の生存戦略
DNAの材料「チミジン」の分解によるガン細胞の生存戦略
17.12.22
DNAの材料「チミジン」の分解によるガン細胞の生存戦略
(17.12.22)
がん細胞におけるチミジン分解経路と解糖系の新たなリンクの発見
Tabata, S., Yamamoto, M., Goto, H., Hirayama, A., Ohishi, M., Kuramoto, T., Mitsuhashi, A., Ikeda, R., Haraguchi, M., Kawahara, K., Shinsato, Y., Minami, K., Atsuro Saijo, A., Hanibuchi, M., Nishioka, Y., Sone, S., Esumi, H., Tomita, M., Soga, T., Furukawa, T. and Akiyama, S.(2017) Thymidine Catabolism as a Metabolic Strategy for Cancer Survival. Cell Rep. 2017 May 16;19(7):1313-1321. doi: 10.1016/j.celrep.2017.04.061.
DNAの構成因子であるチミジンは、"チミジンホスホリラーゼ(TP)"と呼ばれる酵素によって分解される。この反応は、ピリミジンヌクレオシドであるチミジンをチミン(塩基)と2-デオキシ-D-リボース1-リン酸(DR1P)(糖)に分解(異化)する。一方で、TPはさまざまながん細胞で高発現しており、がんの血管新生、がんの浸潤・転移、骨吸収、低酸素抵抗性や抗がん剤耐性に関与することが明らかになっている。しかしながら、TPがどのように腫瘍の進展に寄与するのか、その分子メカニズムについては不明な点が多かった。
慶應義塾大学先端生命科学研究所の田畑特任助教らは、TPが栄養飢餓条件での細胞の生存に寄与することに着目した。通常、長期間の細胞培養をおこなうと生存のための栄養源であるグルコースおよびグルタミンが培地中から枯渇するため、細胞はアポトーシスを引き起こして死んでしまう。しかし、TPを強制発現させた細胞は長時間培養しても生存を維持することができた。これまでの報告で、大腸菌やサルモネラ菌では、TPの異化経路は解糖経路とつながる可能性が指摘されてきた。実際に、サルモネラ菌ではTPによって産生される2-デオキシ- D -リボースの異化代謝が解糖系の炭素源となることで、増殖に寄与していることも明らかになっている。しかしながら、哺乳類細胞におけるチミジンや2-デオキシ- D -リボースの代謝経路は報告されておらず、生理的意義やがんにおける作用についてもわかっていない。
田畑らはTPを発現しているがん細胞を13Cで標識したチミジン(13C5-チミジン)で処理し、チミジンから産生される2-デオキシ-D-リボースがどのような物質に異化代謝されるか検討した。その結果、解糖系中間物質のグルコース6-リン酸 (G6P)や乳酸などに、チミジン由来の13Cが移行していた (図)。このことから、TPを発現しているヒトがん細胞においてもある種の菌と同様、チミジンは解糖系の中間代謝物質へと異化代謝されることが明らかになった。上述のように、田畑らは、TPの強制発現は栄養飢餓抵抗性を持たせることを明らかにしている。このことを併せて考えると、栄養が欠乏している状態ではチミジンは解糖系の炭素源となり、生存に寄与することが予想された。この仮説を検討するために、田畑らはチミジン異化経路の2-デオキシ- D -リボース5-リン酸(DR5P)からグリセルアルデヒド3-リン酸(GAP)へ変換する反応(チミジン分解経路と解糖系をつなぐ酵素反応:図)を阻害して細胞の生存率を調べた。すると、TP発現がん細胞の栄養飢餓抵抗性が低下したことから、チミジンの解糖系物質への異化代謝が細胞死を回避することが明らかとなった。田畑らの予想通り、栄養欠乏状態ではチミジンが解糖系の炭素源となっていたのだ。
さらに、生体内でもチミジンの異化作用が解糖系代謝に関与するかを調べるため、田畑らはTPの酵素活性を欠失させたノックアウトマウスを用いて検討した。このマウスの(TPが高発現している)肝臓の代謝物質を網羅的に測定し、野生型マウスと比較したところ、56代謝物質の量に有意な変化が認められ、その内訳から、解糖系やペントースリン酸経路およびクエン酸回路が顕著に変化していることが分かった。また、TP発現 がん細胞を皮下移植したマウスに13C5-チミジンを投与して代謝追跡した結果、肝臓および がん組織でチミジンが乳酸へと異化されていた。これらの結果から、生体内においてもTPの酵素活性に依存して、チミジンは解糖系物質に異化代謝されることが明らかになった。
TPは胃がんで高発現し、生命予後とも相関することが報告されている。そのため、胃がん組織においてもチミジン異化代謝が亢進し、チミジンがグルコースに変わって解糖系の炭素源として利用されている可能性がある。そこで、田畑らは胃がん組織のチミジン量と2-デオキシ- D -リボース類の量を測定したところ、胃がん組織のチミジンは減少している一方、2-デオキシ- D -リボース類は増加していた。また、チミジン異化代謝が亢進している胃がん組織では、解糖系中間代謝物質の量が増加する傾向にあった。これらの結果から、ヒト胃がん組織おいてもチミジン異化の亢進が解糖系を活性化することが示唆された。
これまで、プリンヌクレオシド(デオキシアデノシンやデオキシグアノシン)の異化経路については理解が進んでいるものの、ピリミジンヌクレオシドであるチミジンの異化経路は良く理解されていなかった。今回の田畑らの研究によって、ヒト細胞においてチミジンが解糖系の炭素源となることが実証され、さらに、この代謝機構ががんの生存に貢献することが明らかになった。
TPは、がんだけでなく関節リウマチやアテローム性動脈硬化などさまざまな疾患において発現が高くなることが知られている。特に、ミトコンドリア神経性胃腸管系脳筋症 (MNGIE) の原因遺伝子であることがすでに報告されている。「これまでのMNGIE研究では、TPの機能欠失による細胞内チミジン量の増加によってヌクレオシドのバランスが崩れ、ミトコンドリアDNAを不安定化してMNGIEが発症すると、考えられています。一方、我々の検討によって、TPの機能を欠失させたマウスでは解糖系の顕著な変化が認められました。これはTPの新しい役割を示唆しています。この役割がTPを高発現する疾患や、MNGIEの病態と関わっている可能性も考えられますし、今後の検討が望まれます。」と田畑特任助教は語った。
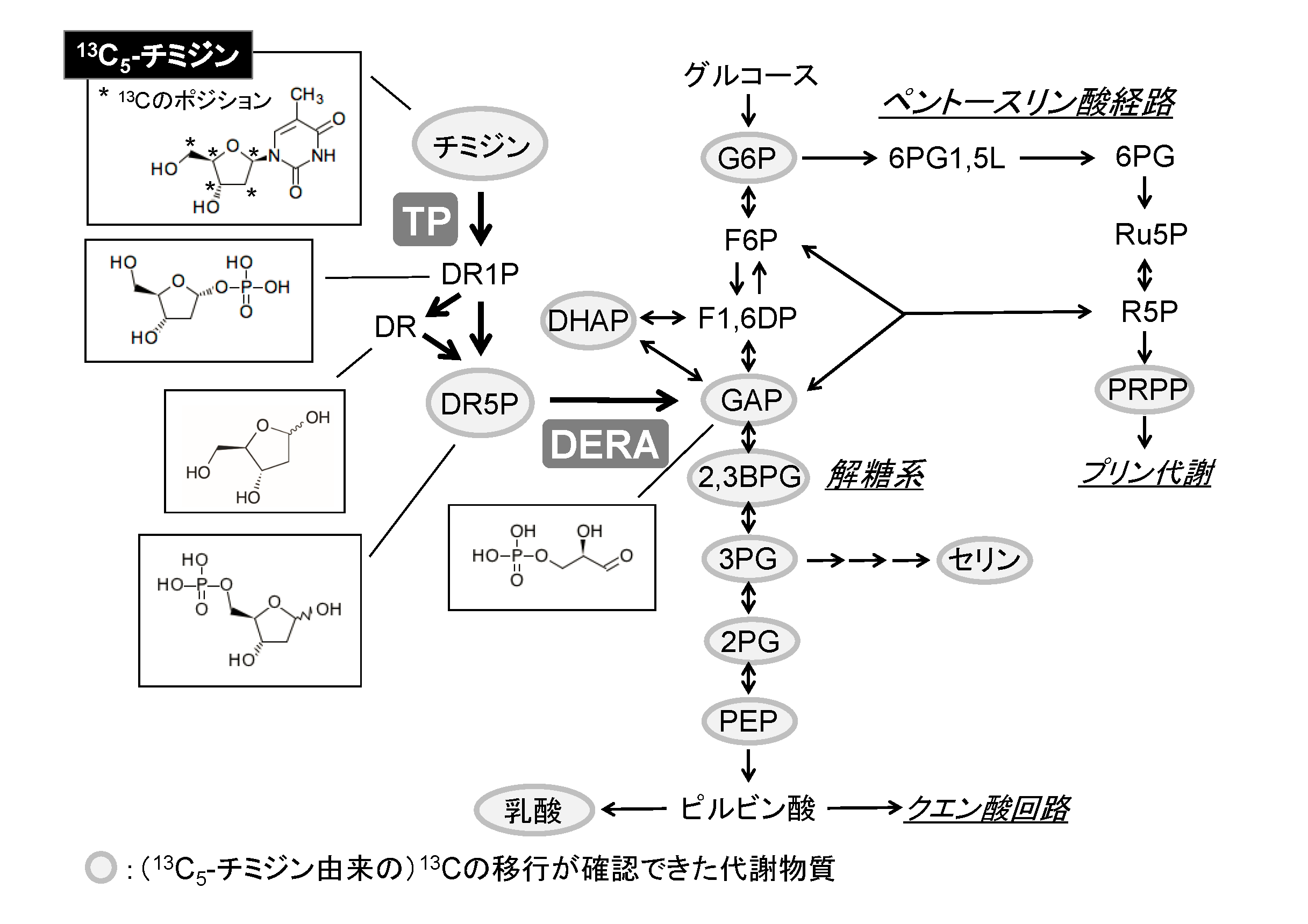

図:チミジン異化代謝経路。TP発現がん細胞を13C5-チミジンで処理して13Cを追跡した結果、解糖系およびその周辺の経路の代謝物質に13Cが移行していた。
[編集:川本 夏鈴]
[編集:川本 夏鈴]