HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  アスベストが原因で発症する悪性腫瘍のメタボローム解析
アスベストが原因で発症する悪性腫瘍のメタボローム解析
19.03.14
アスベストが原因で発症する悪性腫瘍のメタボローム解析
(19.03.14)
悪性胸膜中皮腫における薬剤抵抗に関連する代謝産物を発見
Sato, Y., Matsuda, S., Maruyama, A., Nakayama, J., Miyashita, T., Udagawa, H., Umemura, S., Yanagihara, K., Ochiai, A., Tomita, M., Soga, T., Tsuchihara, K., and Makinoshima, H. (2018).Metabolic characterization of antifolate responsiveness and nonresponsiveness in malignant pleural mesothelioma cells. Front. Pharmaco, Oct 12 2018. 9:1129. doi: 10.3389/fphar.2018.01129.
アスベスト(石綿)は、その耐久性や耐熱性から過去に広く建築材料などとして利用されたが、肺がんや悪性胸膜中皮腫などの健康被害を引き起こすことから大きな問題となっている。アスベストは丈夫で変化しにくいため、蓄積されたアスベストが肺を覆う膜である胸膜に刺さり、約40年もの潜伏期間を経て悪性中皮腫として発症する可能性が非常に高い。それ故に、取り返しのつかない被害をもたらすことになり、現在では、「静かな時限爆弾」とも呼ばれるほど恐れられている。現状としては、悪性胸膜中皮腫の治療には第一選択薬として抗がん剤の一種である「ペメトレキセド(商品名:アリムタ)」が使われており、これは分子構造が似ているビタミンB群の一種である葉酸に拮抗して、DNA合成に関わる3つの酵素を阻害することで作用する。しかし、残念ながら治療成績の指標となる腫瘍縮小効果は36.8%とあまり芳しくない。日本国内では、アスベストを原因とする悪性胸膜中皮腫による死亡者数が増加傾向にあることもあり、希少がんであるがゆえに研究が進展しない側面を超えて、全く新たな治療方法の開発が望まれている。
そこで、慶應義塾大学大学院政策・メディア研究科博士課程の佐藤雄三氏は国立がん研究センターの牧野嶋秀樹氏らとともに、ペメトレキセドがDNAやRNAの合成に関わる核酸の代謝の一部を阻害することに着目した。薬剤による代謝応答を調べることにより、治療の難しい悪性胸膜中皮腫における核酸関連代謝産物の変化を捉えることができる。すなわち、代謝バイオマーカー探索・薬剤耐性機構解明こそ悪性胸膜中皮腫における研究の進展の要と考え、佐藤氏らは本研究に取り組んだ。まず、複数の悪性胸膜中皮腫細胞株おいて、治療薬であるペメトレキセドに対する感受性の違いについて探索した。その結果、細胞株が感受性株と耐性株に分類されることを明らかにし、さらにその中から感受性の高い細胞株2種と最も薬剤耐性の高い細胞株1種を選定した。こうして選定された細胞株における遺伝子発現やタンパク質の発現の解析では薬剤の感受性との関連は見られなかったものの、薬剤が直接阻害する酵素の下流代謝産物(ヒポキサンチンとチミジンの混合液)を加えて薬効が消失するかを調べたところ、感受性株・耐性株いずれにおいても下流代謝産物の添加により薬効が消失されることを見出した。よって、耐性株であってもペメトレキセドによる対象酵素の阻害は起きていることが確認された。
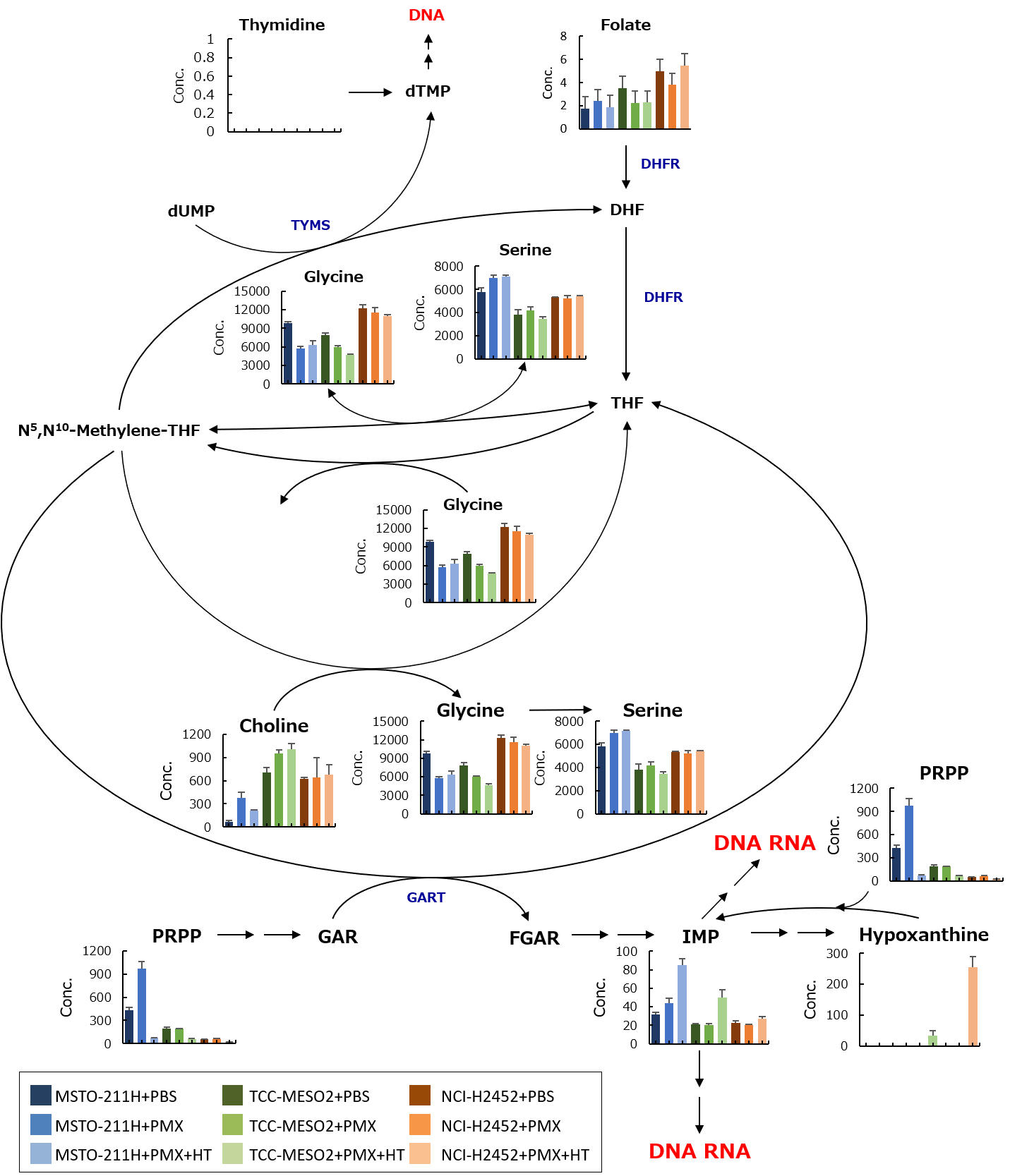
最後に、薬剤単体または薬剤と下流代謝産物を加えた場合の悪性胸膜中皮腫細胞株の代謝産物の変化を捉えるため、メタボローム解析を行った(図)。その結果、感受性株において核酸の合成に関連する一部の代謝産物、特にイノシン酸(IMP)が増減すること、一方で耐性株では大きな変化が見られないことが明らかになった。このことから、悪性胸膜中皮腫において薬剤の効力を予測するためには、イノシン酸などの代謝産物が重要であり、代謝バイオマーカーとなる可能性があることを意味する。本結果を元に、今後悪性胸膜中皮腫における薬剤耐性機構の解明や新規治療法の開発に繋がることが期待される。
[編集:武田知己]