HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  薬剤耐性を誘導する原因遺伝子の特定に成功
薬剤耐性を誘導する原因遺伝子の特定に成功
22.02.21
薬剤耐性を誘導する原因遺伝子の特定に成功
(22.02.21)
悪性胸膜中皮腫のペメトレキセド耐性はチミジン酸合成酵素(TYMS)が関連していることを解明
Sato Y, Tomita M, Soga T, Atsushi Ochiai, Hideki Makinoshima, Upregulation of Thymidylate Synthase Induces Pemetrexed Resistance in Malignant Pleural Mesothelioma, Front. Pharmacol, (2021).
DOI: 10.3389/fphar.2021.718675
悪性胸膜中皮腫は公害の一因とされているアスベスト曝露から約40年という長い潜伏期間を経て、肺を覆う胸膜の内側に生じる侵攻性の悪性腫瘍で、有効な治療法がない。これまで化学療法では第一選択薬としてペメトレキセド(製品名:アリムタ)とシスプラチンの併用療法が行われてきた。しかしながら、療法中に薬剤耐性となる(これら薬が効かなくなってくる)ことが報告されている。ペメトレキセドに対して薬剤耐性となる際に関与していると言われている数種類の遺伝子がこれまで知られているが、実際に薬剤耐性メカニズムにどう関わっているかは解明されていない。
そこで慶應義塾大学大学院政策・メディア研究科博士課程の佐藤雄三氏は、先行研究(過去ハイライト「アスベストが原因で発症する悪性主要のメタボローム解析」を参照)でペメトレキセドを含む培地中にチミジン(Thymidine)を添加することでペメトレキセドの薬効を抑えられたことに着目し、チミジン酸合成酵素(以降、TYMS )がペメトレキセドの薬剤耐性に関わっている仮設を立てた。またペメトレキセドが元々効かない細胞ではペメトレキセドの阻害対象遺伝子の発現がペメトレキセドが良く効く細胞株(ペメトレキセド高感受性細胞株)と比べて有意に低いことから、先天的な薬剤耐性と後天的な薬剤耐性のメカニズムは異なると推察した。まずペメトレキセドに耐性を持つ細胞株(ペメトレキセド耐性細胞株)を人工的に獲得するため、ペメトレキセドを含む培地で2種類のペメトレキセド高感受性細胞株(MSTO-211H, TCC-MESO-2)を約60日間培養した。培地中のペメトレキセドが10 μMに達するまでその濃度を徐々に上げていくことで、ペメトレキセド耐性細胞株を樹立した。次に遺伝子発現解析(RNA-seq)によって、ペメトレキセド高感受性細胞株と今回得られたペメトレキセド耐性細胞株との間でどの遺伝子の発現が変動しているのかを解析した。そして薬剤耐性に関連する責任遺伝子の候補に対し、siRNAによる発現抑制(ノックダウン)と過剰発現を行い、実際に薬剤感受性がどう変化するかを代謝物質の状態とともに調べた。
この結果、RNA-seqによってTYMSの発現がペメトレキセド高感受性細胞株に比べてペメトレキセド耐性株で増加していることが明らかとなった。また、TYMSをノックダウンと過剰発現することでペメトレキセドの薬剤耐性が変化することが分かり、薬剤耐性となる責任遺伝子はTYMSであることが判明した。さらにクロマチン免疫沈降でTYMSの発現増加の要因を探った結果、その発現はプロモーター領域におけるHistone H3の27番目のリジン(K)のアセチル化と関連していることが明らかになった (図A)。
次に、ペトレキセド耐性を獲得することにより細胞内の代謝がどのように変化したかをメタボローム解析で調べた。この結果、ペメトレキセド薬剤処理されたペメトレキセド耐性細胞株の親細胞株では他者の先行研究のとおり細胞内のdTTP(デオキシチミジン三リン酸)が減少していた。一方でペメトレキセド耐性を獲得した悪性胸膜中皮腫細胞株では細胞内のdTTP濃度が維持されていた。このことから、薬剤耐性株でTYMS遺伝子の発現が増加したことで、dTMP(デオキシチミジン一リン酸)の生成が阻害されず、dTTP濃度がそのまま維持されたのだろうと類推した (図 B)。
本研究により化学療法薬の一つであるペメトレキセド(製品名:アリムタ)に耐性の悪性胸膜細胞株を樹立し、その薬剤耐性機構のメカニズムの一因を明らかにすることができた。また、悪性胸膜中皮腫の治療に対する有用な代謝バイオマーカーの探索や薬剤耐性メカニズムのさらなる解明につながる筋道を示した。佐藤氏は「今後の研究でHistone H3の27番目のリジン(K)のアセチル化に関わる因子や先天的なペメトレキセド耐性のメカニズムを明らかにできれば、悪性胸膜中皮腫におけるペメトレキセドの薬効阻害が回避できるようになり治療効果の向上が期待される。」と展望している。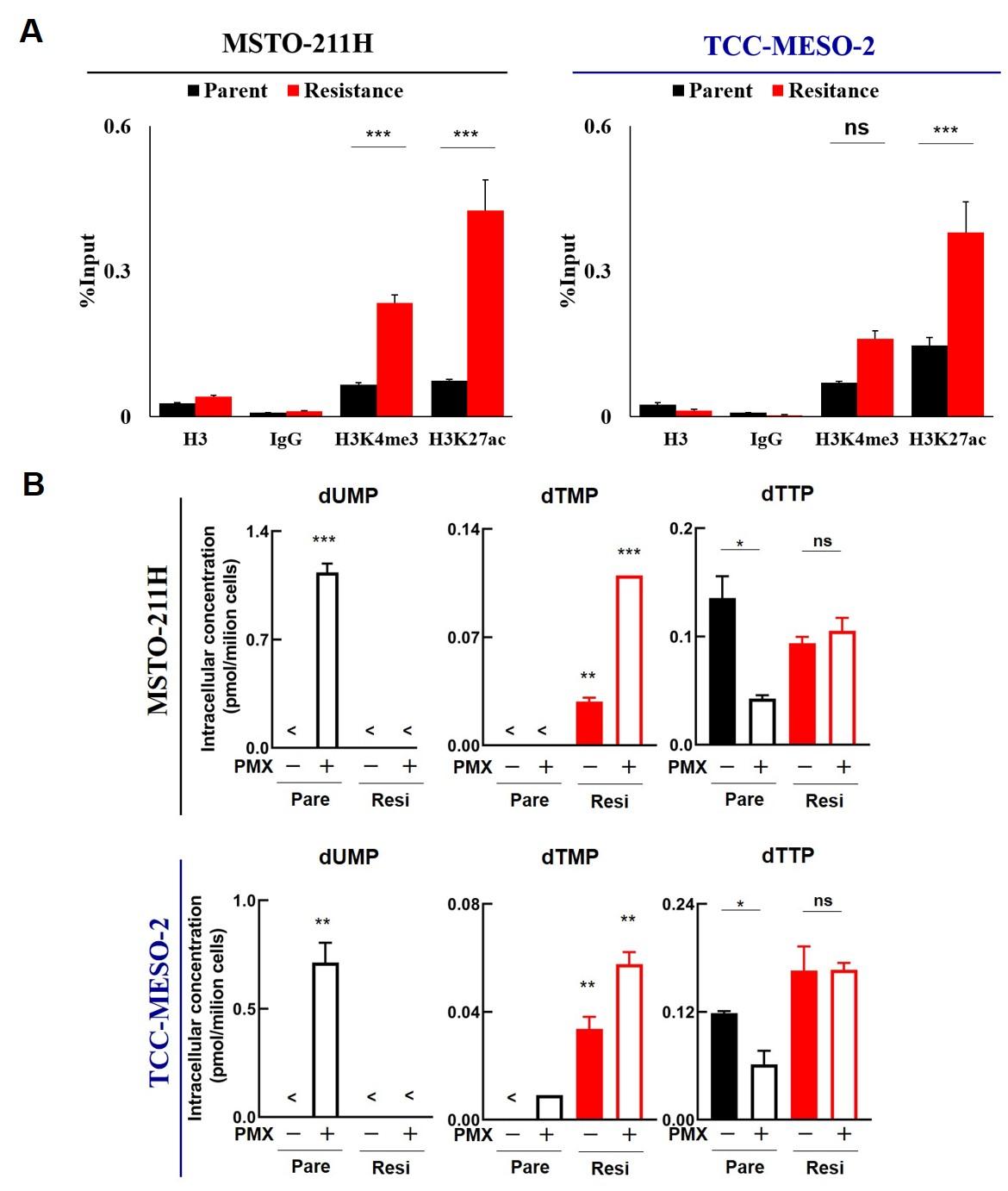
図: A 悪性胸膜中皮腫細胞株(親株 vs 耐性株)におけるTYMSプロモーター領域におけるヒストン修飾の差
図: B悪性胸膜中皮腫細胞株(親株 vs 耐性株)における細胞内の核酸代謝の差
PMX: Pemetrexed, ns: not significant, *P<0.05, **P<0.01, ***P<0.001
[編集: 安在麻貴子]