HOME  論文/ハイライト
論文/ハイライト  研究ハイライト
研究ハイライト  論文ハイライト
論文ハイライト  複製プロセスがバクテリアのゲノム構造を決定していることを証明
複製プロセスがバクテリアのゲノム構造を決定していることを証明
19.10.18
複製プロセスがバクテリアのゲノム構造を決定していることを証明
(19.10.18)
時間の早送りによってゲノム上で塩基組成の偏りが発生するメカニズムを明らかに
Kono N, Tomita M, Arakawa K. (2018) Accelerated laboratory evolution reveals the influence of replication on the GC skew in Escherichia coli. Genome Biol Evol. doi: 10.1093/gbe/evy237.
Kono N, Tomita M, Arakawa K. (2018) Accelerated laboratory evolution reveals the influence of replication on the GC skew in Escherichia coli. Genome Biol Evol. doi: 10.1093/gbe/evy237.
遺伝情報がATGCの4種類の塩基から構成される点は生物に共通したルールであるが、ゲノムのかたちは人間とバクテリアで大きく異なり、ヒトゲノムは線上の構造を持つ一方で、バクテリアゲノムの多くは環状の構造を持っている。バクテリアゲノムのさらなる特徴として、対称的な構造がゲノム上に存在し、例えば、一対の複製開始・終結点が時計の12時、6時の位置にそれぞれ配置されている。さらに、複製開始・終結点を結ぶ軸を中心に、遺伝子(1,000塩基対程度)やオリゴ配列(〜20塩基対程度)の配置など、さまざまな長さのスケールの構造がゲノム上で対称に配置されている。その対称な構造の根幹となるのが、環状ゲノムの塩基組成の偏りであり、複製開始点から終結点に向かう鎖ではG塩基が多く、逆に終結点から開始点に向かう鎖ではC塩基が多くなっている。これらの対称な配置や塩基組成の偏りは、バクテリア内で種を超えて保存され増殖の根幹にも関わる重要なゲノム構造である。それにも関わらず、これらの構造がどのような進化の過程を経て獲得されてきたのか、その実態は明らかになっていなかった。
慶應義塾大学先端生命科学研究所の河野暢明特任講師らは、バクテリアの環状ゲノムが特徴的な塩基組成を獲得する仕組みを実験的に明らかにすることを目指した。河野氏らは既にコンピュータ・シミュレーションを利用し、バクテリアが増殖時に行うゲノムのコピー(複製)の過程が、塩基組成の偏りの構築に影響することを明らかにしていた。シミュレーション結果を実証するためには、実験室内でバクテリアを増殖させながら、ゲノム配列の変化の過程を解析する必要があった。しかしながら、このようなゲノムの変化は、自然界では数百万年かけて起こった変化であり、従来の実験方法で再現しようとすると、実に約4,000年もの時間が必要になってしまう。そこで河野氏らは、脱アミノ化によるC塩基の置換を起こしやすい変異を持った大腸菌株を使用し、さらに、高効率に増殖させ続けることで、変異が入るスピードを加速させることで時間の問題の解決を試みた。また、従来法では検出感度の限界から、通常バクテリアを一度コロニー化させ、特定の遺伝型を「選択」して増幅を伴い観測する必要があったが、この過程で多様な変異が都度収束されてしまい、またその収束にも恣意性が残ってしまう。そこで河野氏らは、バクテリアのコロニー化をあえて行わず、超高感度にゲノム配列を解析することで、多様な母集団に存在するレアな変異を含めて網羅的に観測する手法を用いた。「変異が入るスピードの高速化」と「高感度のゲノム解析技術」を組み合わせた結果、実験室進化後の大腸菌ゲノムからは、従来の実験室内進化と比較して250倍の変異率である~960,000個もの塩基置換が検出された。つまり、数百万年レベルのバクテリアゲノムの進化を実験室のなかで再現することに成功し、これまでは追えなかったゲノム配列の変化過程を解析可能にしたのだ。
実験室内進化によって生じた塩基置換は、ゲノム上で偏って生じているのだろうか?今回の実験で使用された大腸菌株では脱アミノ化による塩基置換を誘導しているため、C塩基の置換が起こりやすい。実験室内進化後の集団に基づいて構築されたゲノムでも、G塩基とC塩基の含有量が減少していたことから、予想通り脱アミノ化によるC塩基の置換がゲノム中で頻繁に起こっていると考えられた。驚くべきことに、C塩基の量は複製開始点から終結点に向かう鎖ではあまり変化しておらず、終結点から開始点に向かう鎖でばかりC塩基の量が減少し、塩基組成の偏りが強くなっていることが明らかになった。しかしながら、この結果だけでは塩基組成の変化が人為的に発生させた塩基置換によるかは不明である。そこで河野氏らは、脱アミノ化によるC塩基置換は一本鎖のDNAで発生することを利用することで、DNA変異が脱アミノ化によるものかを判断することを試みた。具体的には、C塩基の置換が起きている位置と一本鎖DNAが多い領域が一致していれば、DNA変異が脱アミノ化によるものだと考えられる。河野氏らは、二本鎖DNA特異的な消化酵素などを利用することで、バクテリアゲノムの一本鎖DNA検出に利用できる「4S-seq」技術を新規に開発し、DNAの一本鎖が多い領域を特定することに成功した。その結果、一本鎖DNAが多い領域はC塩基の置換が多い領域と一致しており、今回の実験室内進化で得られた塩基組成の偏りは、C塩基に対する脱アミノ化によるものであると考えられた。
では、なぜ脱アミノ化は終結点から開始点に向かう鎖で多く発生したのだろうか?河野氏らは、ゲノムの複製プロセスと転写プロセスに着目し、それぞれの影響を検討した。まず転写プロセスの影響を調べるため、河野氏らは転写が多く発生している領域とC塩基の置換との関係性を検討したが、両者に相関関係は見られず、転写プロセスがC塩基の置換を引き起こす可能性は低いと考えられた。そこで、次に複製プロセスの影響を検討するため、4S-seqを用いて、リーディング・ラギング鎖と変異の相関を調べた。その結果、ラギング鎖が合成されている領域では想定通り一本鎖DNAが多く検出され、偏ったC塩基の置換は転写プロセスよりも複製プロセスが密接に関わっており、ラギング鎖の複製プロセスの過程で生じた一本鎖DNAで置換が頻繁に生じていると考えられる。さらに、変異バイアスが複製プロセスによるものであることをより明確にするため、複製の終結に関連するタンパク質やゲノム構造を欠損させた大腸菌株を利用し、複製の終結点をずらした状態でこれまでと同様の実験室内進化実験とゲノム解析を行った結果、C塩基の置換が多い領域の境界も複製終結点同様にずれた位置に観察された。これらの結果から、バクテリアゲノムにおけるDNA変異のバイアスは、複製プロセスによって引き起こされるものであると河野氏らは結論づけた。
本研究の成果について、河野特任講師は「過去の論文3報(Kono, et al., 2017; Kono, et al., 2014; Kono, et al., 2012)の集大成であり、人生でもっとも長く時間をかけた論文です。この論文によって、DNA複製がゲノム構造の大きな方向性を決定づけることを示唆できたと思っています。」と語る。今後の展開については、「微生物全般に広げてみると、塩基置換の方向性にもバラエティがあることから、塩基置換を引き起こすさまざまなメカニズムが協調することで、バクテリア固有の塩基配列が獲得されてきたのではないかと考えられます。今回、我々が開発した4S-seqの手法は他の種に対しても有効なので、この手法を利用して各バクテリアが辿ってきた過程を明らかにしたいです。最終的には、生命やゲノムがどのようにデザインされてきたかを理解して生命・ゲノムのデザインルールを整備し、近い未来に訪れるであろう全ゲノム合成時代の基盤を作っていきたいです。」と語った。
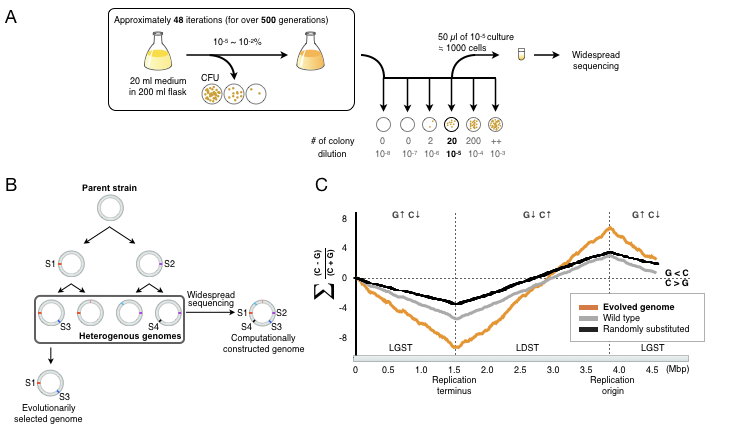 図AおよびB:本研究の手法の概要図。バクテリアのコロニー化によるボトルネックをなくし、ゲノム集団の多様性を維持したまま継代培養していく。最終的にゲノム集団を一括シーケンスし、バイオインフォマティクスによって変異箇所を収集する。
図AおよびB:本研究の手法の概要図。バクテリアのコロニー化によるボトルネックをなくし、ゲノム集団の多様性を維持したまま継代培養していく。最終的にゲノム集団を一括シーケンスし、バイオインフォマティクスによって変異箇所を収集する。
図C:本手法によって、ゲノム中の塩基組成の偏りを再現することに成功した。
 図AおよびB:本研究の手法の概要図。バクテリアのコロニー化によるボトルネックをなくし、ゲノム集団の多様性を維持したまま継代培養していく。最終的にゲノム集団を一括シーケンスし、バイオインフォマティクスによって変異箇所を収集する。
図AおよびB:本研究の手法の概要図。バクテリアのコロニー化によるボトルネックをなくし、ゲノム集団の多様性を維持したまま継代培養していく。最終的にゲノム集団を一括シーケンスし、バイオインフォマティクスによって変異箇所を収集する。図C:本手法によって、ゲノム中の塩基組成の偏りを再現することに成功した。
[編集:河野夏鈴]